
Fisica Generale
Test di apprendimento di Termodinamica
Leggere le risposte solo dopo aver accuratamente riflettuto sulle risposte date precedentemente
-
Definire la viscosità di un fluido
La viscosità di un fluido è conseguenza dell'attrazione reciproca delle sue molecole.
Il coefficiente di viscosità in una tubatura è la forza di attrito che si
esercita per unità di sezione, per unità di lunghezza per
velocità unitaria e si misura in Kg / (m x s).
-
Definire la temperatura
La temperatura è una grandezza fisica intensiva che misura lo stato termico di un corpo.
La temperatura assoluta si misura in gradi Kelvin (la temperatura del ghiaccio fondente e dell'acqua bollente
sono pari a 273.16K e 373.16K rispettivamente) ed è correttamente definita come quella scala termometrica
tale da far sì che il rendimento di una macchina di Carnot sia pari all'unità diminuita del rapporto
fra la temperatura inferiore e la temperatura superiore alle quali la macchina lavora.
La temperatura è inoltre proporzionale alla energia cinetica media delle molecole.
-
Definire il calore
Il calore è l'energia termica che può fluire da un corpo ad un altro durante una trasformazione
termodinamica. Si può misurare in calorie ovvero in Joule tramite l'equazione di equivalenza 1Q=4.186J
-
Quando un gas può essere definito ideale e perché?
Un gas ideale è tale che le sue molecole sono prive di volume e non interagiscono mai salvo che
non si trovino a distanza nulla (urti). Un gas reale approssima abbastanza bene il comportamento ideale se i valori
di temperatura, pressione e volume sono abbastanza al di sopra del punto critico e comunque il gas si trovi
in condizione di elevata rarefazione, quando, cioè, l'attrazione fra le molecole è debolissima
(molecole molto lontane) e quando il loro volume è trascurabile rispetto al volume del recipiente
che le contiene.
-
Disegnare un grafico che indichi (qualitativamente) una trasformazione isoterma, una trasformazione isobara,
una trasformazione isocora una trasformazione adiabatica per un gas ideale
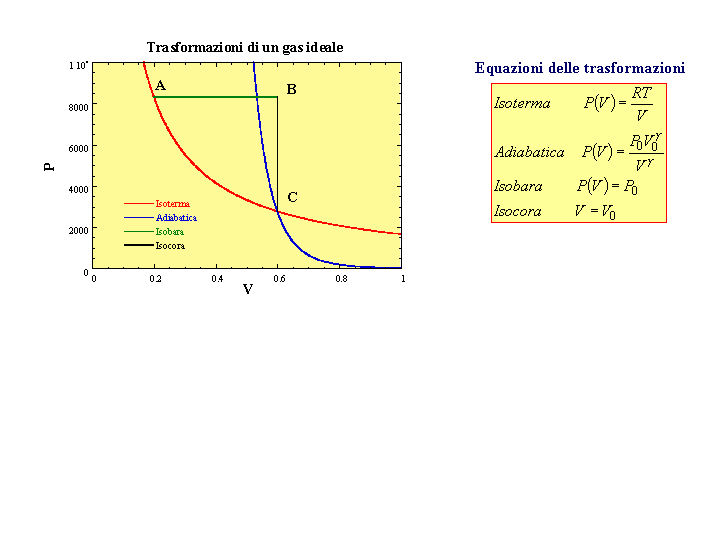
-
Definire l'Energia Interna.
La definizione dell'energia interna coincide col Primo Principio della Termodinamica. L'energia interna è
una funzione di stato che tiene conto del bilancio energetico di un sistema termodinamico durante una trasformazione.
Le sue variazioni (essa è definita a meno di una costante, p.es. l'energia interna del sistema allo
zero assoluto) dipendono solo dagli stati iniziali e finali di una trasformazione e non dalla particolare trasformazione,
e si possono definire come somma di tutti i possibili scambi energetici del sistema ottenuti al variare
delle variabili di stato estensive. Per un gas perfetto le sue variazioni sono anche pari al calore scambiato a volume costante.
-
Definire l'Entropia.
La definizione di entropia coincide con il Secondo Principio della Termodinamica. L'entropia è una funzione
di stato che varia per ragioni esterne ed interne ad un sistema termodinamico durante una trasformazione ma le cui
variazioni dipendono solo dallo stato iniziale e finale e non dalla particolare trasformazione. Le sue variazioni
per cause esterne sono tali che producono una variazione differenziale dell'entropia tale che dSe=dQ/T
(dQ non è un differenziale esatto ma dS lo è). La sue variazioni per cause interne, dSi
non sono generalmente esprimibili analiticamente ma non possono essere negative. La conseguenza diretta di ciò è
che l'entropia di un sistema isolato non può diminuire mai, quindi deve tendere ad un massimo
(equilibrio termodinamico).
-
Definire l'Entalpia.
L'entalpia è il potenziale termodinamico per le variabili di stato entropia, pressione e numero di
moli e le sue variazioni sono pari al calore scambiato dal sistema a pressione e numero di moli costanti
-
La pressione idrostatica all'interno di un liquido è
-
indipendente dalla direzione
-
costante
-
non dipende dalla profondità
Spiegazione:
La pressione all'interno di un liquido può cambiare con la profondità (legge di Stevino), può essere costante ma
non nel campo della gravità terrestre, ma è certamente indipendente dalla direzione (risp.1) a causa della simmetria
sferica nella distribuzione spaziale delle molecole di un fluido
-
A mare un corpo galleggia se
-
è più leggero dell'acqua di mare
-
il suo peso specifico è minore di quello dell'acqua (p.es. il legno galleggia mentre l'acciaio affonda)
-
la sua densità media è inferiore a quella dell'acqua di mare
Spiegazione:
La prima risposta è priva di senso, in quanto bisogna specificare di "QUANTA" acqua di mare il corpo è più leggero.
La seconda non può essere corretta poiché, ad es., un transatlantico d'acciaio galleggia. La terza è corretta, infatti
una nave d'acciaio contiene al suo interno grandi spazi vuoti da far sì che il rapporto della massa totale sul volume
(=densità media) sia inferiore a quello dell'acqua.
-
Il numero di Reynolds è una costante per un dato fluido
-
Falso: dipende dalla temperatura
-
Vero: dipende solo da quantità costanti come la densità e la viscosità
-
Vero: ma solo se il recipiente che contiene il fluido non è molto grande
Spiegazione:
Ogni grandezza fisica dipende dalla Temperatura. Pertanto anche il numero di Reynolds che è
proporzionale alla densità ed inversamente proporzionale alla viscosità vi dipende. La prima risposta è dunque
corretta, la seconda è incorretta e la terza è priva di senso, perché le dimensioni del recipiente, che pure
c'entrano col numero di Reynolds, sono irrilevanti per renderlo costante o variabile.
-
Due corpi in contatto termico sono in equilibrio termico se
-
hanno raggiunto la stessa temperatura
-
hanno raggiunto la stessa entropia
-
hanno raggiunto la stessa pressione
Spiegazione:
L'equilibrio termico di un sistema fisico (ovvero della unione di più sottosistemi) si raggiunge quando la
temperatura è uniforme (quindi la stessa per due corpi in contatto termico). Parimenti all'equilibrio l'Entropia
di tutto il sistema sarà massima (se il sisitema è isolato) ma non deve necessariamente essere la stessa l'Entropia
dei due singoli sottosistemi (p.es. uno potrebbe essere molto più esteso dell'altro e L'Entropia è una variabile
estensiva). La pressione all'equilibrio deve essere uniforme, ma se i due corpi fossero solidi il suo valore sarebbe
irrilevante per stabilire l'equilibrio termico. Pertanto va scelta la prima risposta.
-
Il calore specifico è
-
la quantità di calore impiegata in una specifica trasformazione
-
la quantità di calore posseduta dall'unità di massa di un corpo in una specifica trasformazione
-
la quantità di calore che se somministrata ad un corpo di massa unitaria ne fa innalzare la sua temperatura
di un grado
Spiegazione:
La terza risposta altro non è che la definizione di calore specifico. La seconda è concettualmente sbagliata perché
il calore non si possiede ma transita da un sistema ad un altro. La prima è semplicemente ridicola.
-
A due corpi alla stessa temperatura viene fornita la stessa quantità di calore. Al termine di questo
processo i due corpi possono avere temperature diverse.
-
Vero perché il calore potrebbe essere stato fornito secondo diversi procedimenti
-
Vero perché i due corpi potrebbero avere diversi calori specifici
-
Vero perché i due corpi potrebbero avere diverse capacità termiche
Spiegazione:
Entrambe la prima e la terza sono corrette. La prima perché una stessa quantità di calore potrebbe essere ceduta
in maniera diversa (p.es. a pressione costante o a volume costante) portando i sistemi in due stati termodinamici diversi.
La terza è corretta perché se le capacità termiche sono diverse con la stessa quantità di calore si otterranno
temperature finali diverse. La seconda è invece inesatta, poiché sarebbe vera SOLO se le masse dei due corpi fossero uguali
(in tal caso avrebbero la stessa capacità termica).
-
A pressione costante, se il volume si dimezza cosa fa la temperatura di un gas ideale?
-
Domanda senza senso: se il gas viene compresso la pressione deve aumentare e non può restare costante
-
raddoppia
-
si dimezza
Spiegazione:
L'equazione di stato dei gas perfetti (PV=nRT) chiarisce che la risposta corretta è la terza, poiché temperatura
e volume sono proporzionali a pressione costante. La prima è errata, in quanto comprimendo il gas la pressione aumenta
se la temperatura si mantenesse costante. La seconda è semplicemente sbagliata.
-
Una trasformazione termodinamica che avviene in maniera estremamente veloce è
-
adiabatica: perché non c'è tempo di scambiare calore con l'esterno
-
isoterma: perchè la temperatura non fa in tempo a cambiare
-
isobara: perchè la pressione non può cambiare visto che è il risultato della diffusione
delle molecole e ci vuole del tempo prima che queste diffondano
Spiegazione:
Il calore per fluire da un sistema ad un altro necessità di tempo (deve essere ceduto ed assorbito). Una espansione però
potrebbe essere molto veloce (si pensi al movimento del pistone di un motore a scoppio). In tal caso la pressione
all'interno del cilindro diminuirà altrettanto velocemente (è infatti la compressione del gas nella camera di scoppio che
produce l'espansione), rendendo la terza risposta sbagliata. Sempre nell'esempio del pistone, la temperatura varierà
altrettanto velocemente (dopo lo scoppio), anzi se non variasse il rendimento del motore sarebbe nullo (ovvero non siù
potrebbe avere una macchina termica). Pertanto solo la prima risposta è corretta.
-
Non sempre la temperatura di un corpo varia quando esso scambia calore con l'esterno.
-
Ovvio: calore e temperatura sono due grandezze termodinamiche indipendenti
-
Vero: si pensi alle transizioni di fase
-
Falso: infatti cedendo una quantità di calore pari alla capacità termica all'ambiente esterno
la temperatura del corpo deve diminuire di un grado
Spiegazione:
La seconda risposta fornisce l'esempio illiminante che risponde esaustivamente al quesito. Il fatto che calore e
temperatura siano grandezze indipendenti non esclude che per aumentare o diminuire la temperatura di un sistema
fisico gli si possa cedere o prelevare del calore (anzi nella maggior parte dei casi è così!). La terza sarebbe vera
se non esistessero (e per fortuna esistono!) le transizioni di fase.
-
Uno stato termodinamico è univocamente definito se si conoscono
-
Pressione, Temperatura, Volume, numero di particelle e specie chimiche
-
l'insieme delle variabili di stato indipendenti e delle equazioni di stato
-
l'insieme delle equazioni di stato
Spiegazione:
La prima risposta sarebbe corretta se quelle indicate fossero le sole variabili di stato, cioè si fosse nel caso
di assenza di scambi energatici di natura elettrica, magnetica, elettromagnetica, nucleare, ecc.. Se si conoscono
delle equazioni di stato, ogni equazione consentirebbe di eliminare una variabile di stato (p.es. la temperatura
conoscendo pressione, volume e numero di moli con un gas perfetto). Ma per definire uno stato almeno una variabile
di stato indipendente è necessaria (p.es. per un gas perfetto U(T)), pertanto la risposta 3 è insufficiente
mentre la seconda risposta è corretta.
-
Una variabile di stato è
-
una grandezza fisica che descrive una proprietà macroscopica di un sistema termodinamico all'equilibrio
-
una grandezza fisica che descrive una proprietà macroscopica di un sistema termodinamico
-
una grandezza fisica intensiva che descrive una proprietà macroscopica di un sistema termodinamico
all'equilibrio (p.es. la Temperatura)
Spiegazione:
La prima risposta è evidentemente corretta. La seconda è invece errata, in quanto la richiesta dell'equilibrio
è indispensabile non solo per definire ma anche per misurare la variabile di stato. La terza escluderebbe l'esistenza
di variabili di stato estensive quali Volume, numero di moli, Entropia, ecc., pertanto non può essere corretta.
-
Una funzione di stato è
-
una relazione che collega le variabili di stato
-
una funzione delle sole variabili di stato
-
una funzione che definisce una trasformazione termodinamica da uno stato ad un altro
Spiegazione:
La seconda risposta è evidentemente corretta. La prima è piuttosto la definizione di equazione di stato, mentre la
terza è l'equazione che in qualche piano descrive una trasfromazione termodinamica (p.es. l'equazione politropica
del gas perfetto nel piano di Clapeyron)
-
Il Primo principio della Termodinamica afferma che
-
non è possibile che in una trasformazione termodinamica il calore passi spontaneamente da un corpo
freddo ad uno caldo
-
l'energia non si crea e non si distrugge quindi il lavoro effettuato è sempre pari all'energia assorbita
-
se l'energia assorbita durante una trasformazione è maggiore dell'energia
ceduta allora l'energia interna aumenta
Spiegazione:
La prima risposta, benché forse corretta, si riferisce al secondo principio e non al primo. La seconda è errata, in quanto
una parte dell'energia assorbita potrebbe (e ciò avviene quasi sempre) trasformarsi in calore, ovvero essere distribuita
ai gradi di libertà interni (microscopici) del sistema. La terza risposta, invece, chiarisce il corretto bilancio
energetico e sottintende pure che l'energia interna sia una funzione di stato, visto che non fa riferimento alle
modalità particolari (trasformazione termodinamica) con cui avvengono gli scambi energetici.
-
Una macchina termica assorbe Q Kcal da una sorgente termica e ne cede Q/2 ad un'altra.
Il rendimento della macchina è
Spiegazione:
La seconda e la terza sono banalmente errate perché il rendimento di una macchina deve essere compreso fra 0 ed 1.
Il rendimento di una macchina termica qualunque è dato dal lavoro ottenuto nella trasformazione ciclica rapportato alla
energia in entrata (in questo caso Q). Nel caso in questione, visto che comunque per una macchina termica la trasformazione deve
essere ciclica, il lavoro ottenuto è al massimo Q-Q/2=Q/2. Tuttavia va aggiunto che tale rendimento è comunque solo
teorico, perché non sono difficilmente evitabili dispersioni di energia (per attriti o altro).
-
Il rendimento di una macchina termica tende ad 1 quando
-
è una macchina ideale che lavora senza attriti
-
si tratti di una Macchina di Carnot che lavori fra due temperature enormemente diverse
-
si tratti di una Macchina di Carnot che lavori fra due temperature vicinissime
Spiegazione:
Il rendimento di una macchina di Carnot è 1-T2/T1, ed è una macchina ideale che lavora SENZA
attriti. Pertanto la prima risposta è sbagliata oltre che incompleta, la terza è una svista in quanto se le temperature
fossero uguali il rendimento sarebbe nullo, ma la seconda sarebbe corretta se T1 fosse molto maggiore di
T2.
-
Una trasformazione è irreversibile quando
-
dura un tempo breve
-
può avvenire solo in un verso
-
non passa per tutti gli stati termodinamici intermedi
Spiegazione:
La risposta corretta è la terza, perché se una trasformazione non avviene passando fra stati termodinamici (di
equilibrio) facendo variare tutte le variabili di stato di quantità infinitesime non può essere reversibile, in quanto non
si potrà tornare indietro ripassando dagli stessi stati. Tale trasformazione, però, potrebbe avvenire anche in tempi brevi
(p.es. se lo stato finale è infinitamente vicino a quello iniziale). La seconda è errata, perché si può andare da uno stato
A ad uno stato B con una trasformazione irreversibile ma poi è sempre possibile tornare da A a B (p.es. con un'altra
trasformazione irreversibile).
-
Il Secondo Principio della Termodinamica afferma che
-
non è possibile trasformare integralmente in lavoro il calore scambiato in un processo ciclico
-
non è possibile realizzare una trasformazione ciclica il cui unico risultato è il trasferimento
di calore da un corpo freddo ad uno caldo
-
non è possibile trasformare in lavoro il calore scambiato con una sola sorgente a temperatura costante
Spiegazione:
La seconda risposta è semplicemente l'Enunciato di Clausius, pertanto è corretta. La prima e la terza sarebbero corrette
sostituendo alle parole "calore scambiato" le parole "tutto il calore scambiato", ed in tale caso corrisponderebbero
all'Enunciato di Kelvin.
-
Alternativamente il Secondo Principio della Termodinamica afferma che
-
Esiste l'entropia, una funzione di stato destinata ad aumentare in ogni trasformazione irreversibile anche se ciclica
-
Esiste l'entropia, una funzione di stato destinata ad aumentare in ogni trasformazione di un sistema isolato
-
Esiste l'entropia, una funzione di stato che per un sistema isolato non può diminuire mai
Spiegazione:
Visto che l'Entropia è una funzione di stato, e che lo stato iniziale e finale di una trasformazione ciclica
coincidono, la prima risposta è necessariamente errata: l'Entropia dello stato iniziale è la stessa di quello
finale. La seconda e la terza sono invece entrambe esatte, poiché affermano esattamente la stessa cosa.
-
Il Secondo Principio della Termodinamica vieta che
-
L'entropia di un essere vivente diminuisca
-
L'entropia di un ciclo di Carnot resti costante
-
L'entropia dell'universo diminuisca
Spiegazione:
Dato che l'universo è un sistema isolato la terza è corretta. Per quanto riguarda la prima è ovvio che un essere vivente
non è isolato, e pertanto può ridurre la propria entropia (a spese dell'ambiente che lo circonda). La seconda è sbagliata
perché l'entropia è una funzione di stato (vedi quesito precedente)
-
In un gas a numero di moli fissato
-
L'energia interna dipende solo dalla temperatura
-
L'energia interna non dipende dalla temperatura
-
L'energia interna dipende da temperatura e volume
Spiegazione:
Dato che ogni grandezza fisica dipenda dalla tempetratura, la seconda risposta è sbagliata. La prima sarebbe corretta
se il gas fosse perfetto, mentre la terza si applica ad un gas reale (in assenza di campi esterni)
-
La pressione interna (Eq. di Van der Waals) in un gas reale è
-
Il risultato della media delle interazioni fra le particelle
-
Il risultato della media delle interazioni a corta distanza fra le particelle
-
Una conseguenza diretta del fatto che il covolume è non nullo
Spiegazione:
A corta distanza due particelle si respingono e ciò fa sì che si possa definire (in media) un covolume, correzione
di Van Der Waals relativa al volume disponibile (V-b al posto di V), non alla pressione interna. Pertanto la seconda
e la terza risposta sono entrambe sbagliate. La seconda è invece corretta perché la pressione interna tiene conto
(in media) della attrazione a lungo e medio raggio tra le particelle (che sono rallentate nella corsa verso le pareti)
e di eventuali urti (interazione a corto raggio) che impediscono alle particelle di raggiungere le pareti.
-
Se la pressione varia alla coesistenza di due fasi la temperatura varierà. Vero o falso?
-
Domanda trabocchetto: alla coesistenza la pressione resta costante (vedi curve di Andrews)
-
Vero
-
Falso
Spiegazione:
Alla coesistenza di fase una variazione di volume non farà cambiare né la pressione né la temperatura (cfr. Curve di
Andrews). Ma se si forza un cambiamento di pressione la coesistenza si potrà avere solo passando ad un'altra
isoterma. Pertanto solo la seconda risposta è corretta o sensata.
-
Come realizzereste un termometro che possa misurare temperature altissime e bassissime?
-
Mettendo un gas in contatto termico col corpo di cui si vuole misurare la temperatura (in un recipiente molto
grande) e misurando le variazioni di volume e di pressione del gas
-
Con il mercurio, in un vaso capillare estremamente lungo e con moltissime tacche
-
Costruendo una macchina termica che lavori fra una temperatura nota e quella da determinare
Spiegazione:
La prima progetta un termometro non realizzabile, in quanto si dovrebbe conoscere esattamente l'equazione di stato del gas,
cosa possibile solo per un gas perfetto, che a sua volta non esiste (a parte il fatto che la variazioni di volume di un
recipiente grande potrebbero essere trascurabili rispetto al volume del recipiente stesso). La seconda risposta è
un po' ridicola e presuppone che la dilatazione del mercurio sia lineare a temperature basse o alte (il che non è, a parte
il fatto che il mercurio per temperature molto basse solidificherà). La terza risposta corrisponde alla costruzione di una
macchina elettrica detta termocoppia, che può lavorare fra due temperature di cui una nota (p.es. il ghiaccio fondente)
sfruttando gli effetti termoelettrici (Peltier e Seebeck).
-
In un gas le molecole sono biatomiche, possiedono momento di inerzia I ed i loro nuclei possono vibrare con frequenza
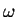 . A temperatura T l'energia cinetica media per molecola
del gas è
. A temperatura T l'energia cinetica media per molecola
del gas è
Spiegazione:
In un gas perfetto l'energia cinetica media è KBT/2 per ogni grado di libertà della molecola. Una molecola
biatomica possiede tre gradi di libertà traslazionali e due rotazionali (due assi perpendicolari alla congiungente le molecole).
Pertanto la risposta corretta è solo la prima.
Scaletta punteggi:
Risposte corrette da
0-18 = Insufficiente
19-21 = Sufficiente
22-24 = Discreto
25-27 = Buono
28-30 = Ottimo
31-32 = Eccellente


